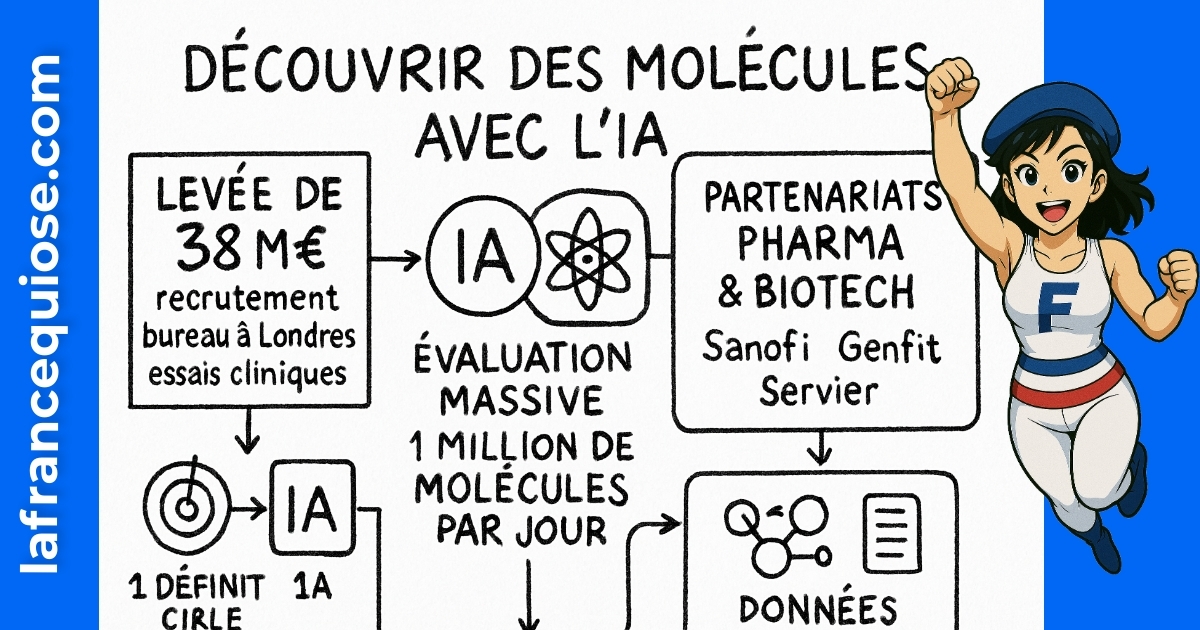
Levée de fonds, science dure et exécution commerciale. Aqemia annonce 38 M€ pour accélérer la prédiction de l’efficacité des molécules thérapeutiques, avec un cap : réduire drastiquement le temps entre l’idée et l’essai clinique.
IA générative, physique théorique, bureau à Londres et premières preuves avec des partenaires comme Sanofi : le mouvement est clair. Si tu travailles en biotech, pharma ou data, retiens ce qui suit et adapte ton plan dès maintenant.
| Habitué au story des 15 secondes ? Voilà ce que tu dois retenir : |
|---|
| ✅ 38 M€ pour passer de la découverte à des essais cliniques avant fin 2025 🚀 |
| ✅ 1 million de molécules/jour évaluées, soit 10 000x plus vite que les approches classiques ⚡ |
| ✅ Bureau à Londres pour scaler le dealflow et attirer des profils R&D/BD internationaux 🌍 |
| ✅ Partenariats stratégiques (ex. Sanofi) comme levier de validation et d’accès clinique 🤝 |
Aqemia lève 38 M€ : comprendre l’impact business derrière l’anticipation de l’efficacité des molécules
Une levée n’est pas un trophée, c’est un outil. Dans le cas d’Aqemia, ces 38 M€ doivent transformer une prouesse scientifique en pipeline clinique tangible. L’ambition est claire : prédire avec fiabilité l’efficacité de candidats médicaments, réduire le nombre d’itérations en laboratoire et concentrer les budgets sur les molécules à plus forte probabilité de succès.
Le tour est mené par Cathay Innovation, avec Wendel, Bpifrance Large Venture, Eurazeo et Elaia. Le financement est en equity, ce qui laisse entendre une confiance dans l’exécution et un alignement long terme. Depuis 2019, le total cumulé atteint environ 98,1 M€, de quoi financer la R&D, structurer la fonction clinique et accélérer l’expansion internationale.
L’angle décisif : raccourcir le cycle décisionnel. Dans une industrie où chaque mois de délai peut coûter des millions, la vitesse d’évaluation des molécules change l’économie du risque. Au lieu de dépendre exclusivement d’essais coûteux, le criblage computationnel de 1 million de molécules par jour dégage un tri initial massif et ciblé.
L’histoire éclaire la thèse : née de recherches menées au CNRS et à l’ENS-PSL par Maximilien Levesque, la technologie relie la physique statistique à la découverte de médicaments. Le passage par Start-Ulm en 2017 sert de test marché. L’appui de PSL Valorisation puis du PSL Innovation Fund catalyse le spin-off en 2019. L’arrivée d’Olivier Vaury (business angel) et d’Emmanuelle Martiano (ex-BCG) structure le pilier business. Résultat : une trajectoire deeptech assumée et lisible.
Sur le plan concurrentiel, l’entreprise se place face à Recursion, Insilico Medicine, Relay Therapeutics et Schrödinger. En France, Qubit Pharmaceuticals et Owkin tiennent aussi la corde. La différence n’est pas le storytelling, mais l’algorithme et son rendement. L’algorithme doit produire du signal utile, pas des slides.
Comment exploiter ce virage si tu es côté pharma ou biotech ? En branchant plus tôt des évaluations in silico, en posant des critères de go/no-go clairs, et en documentant la corrélation entre les prédictions et les résultats précliniques. Pas d’effets de mode : des métriques, des cohortes, des preuves.
- 🎯 Priorise des cibles où la donnée est abondante pour entraîner et valider les modèles.
- 🧪 Exige une traçabilité complète des hypothèses et des paramètres de scoring.
- 📈 Suit des KPIs concrets : taux de succès en lead optimization, économies de cycles wet lab.
- 🤝 Négocie des milestones liés à des résultats mesurables (et pas à des livrables de présentation).
Au-delà du chèque, le vrai signal est opérationnel : doublement des effectifs vers 120 personnes, ouverture à Londres, et premières étapes cliniques. L’essentiel est de maintenir la vitesse sans brûler la précision. Un tri computationnel qui ne se traduit pas en résultats au banc n’a aucune valeur. Ici, la promesse tient sur la capacité à prédire utile.
| Élément | Détail | Signal pour le marché |
|---|---|---|
| 💶 Montant | 38 M€ (equity) | Capacité à financer R&D et pré-clinique |
| 🤝 Lead | Cathay Innovation | Crédibilité growth + réseau international |
| 🌍 Expansion | Londres comme hub | Accès talents BD/clinique et capitaux anglo-saxons |
| 🧬 Objectif | Essais cliniques avant fin 2025 | Validation du modèle par le résultat, pas par le discours |
Moralité : quand la techno réduit le risque et le temps, elle revalorise tout le pipeline.
À lire également :
Altice, le géant des télécoms français, navigue une période stratégique majeure. Pour assainir sa dette colossale et préparer la vente possible de sa filiale SFR,…
Physique théorique + IA générative : comment Aqemia prédit l’efficacité des candidats médicaments
La proposition de valeur tient en une phrase : des algorithmes mêlant physique statistique, éléments de physique quantique et IA générative pour estimer très vite et très précisément l’affinité et l’activité de molécules. Cette approche contourne des approximations coûteuses et accélère le tri, sans sacrifier la qualité du signal.
Traduction opérationnelle : au lieu de tester laborieusement des bibliothèques limitées, le modèle génère et évalue à l’échelle, puis oriente les chimistes sur des candidats optimisés. Le passage de l’espace chimique théorique à des séries synthétisables devient plus court et mieux instrumenté.
Du scoring massif à la décision: pipeline type
Un pipeline maîtrisé suit quatre phases. D’abord, la définition de la cible biologique et la collecte de données structurées. Ensuite, la génération assistée par IA de familles moléculaires cohérentes avec les contraintes. Puis, l’évaluation en masse (jusqu’à 1 million/jour) avec un modèle physico-statistique propriétaire. Enfin, la sélection priorisée pour le wet lab, avec boucles de rétroaction sur les résultats expérimentaux.
La différence se joue sur la qualité des features et la capacité du modèle à généraliser. Les approches de type docking brut ne suffisent pas à cette échelle. L’ajout de contraintes physiques permet de filtrer plus intelligemment et d’éviter les faux positifs classiques.
- ⚙️ Étape 1 – Cible et données : définir les endpoints, curer les datasets, fixer les tolérances.
- 🧠 Étape 2 – Génération : proposer des scaffolds variés, éviter la redondance, respecter la synthétisabilité.
- 🚀 Étape 3 – Évaluation : scorer à grande échelle, classer, détecter les outliers.
- 🔁 Étape 4 – Boucle : confronter aux assays, réentraîner, itérer vite.
L’enjeu n’est pas d’annoncer une vitesse théorique. C’est d’obtenir des séries qui passent les tests en cascade et minimisent les itérations coûteuses. Lorsque le modèle te fait gagner deux cycles de synthèse, le ROI devient évident et répétable. C’est là que l’IA change la donne : produire un apprentissage cumulatif qui affine la stratégie au fil des campagnes.
| Approche | Vitesse | Précision attendue | Implication opérationnelle |
|---|---|---|---|
| 🔬 Criblage wet lab seul | Semaine-mois | Variable | Coûts élevés, faible couverture de l’espace chimique |
| 🧩 Docking classique | Rapide | Moyenne | Risque de faux positifs, besoin de post-filtrage intensif |
| ⚛️ Aqemia (IA + physique) | Jusqu’à 1 M/jour | Haute, guidée par contraintes physiques | Tri massif, 10 000x plus vite, meilleure priorisation |
La spécialisation en oncologie sert de terrain d’excellence : complexité moléculaire élevée, besoins médicaux, données denses. Mais la méthode se transpose à d’autres aires thérapeutiques. Quand la base est solide, la verticalisation par pathologie suit naturellement, avec des librairies dédiées et des métriques adaptées.
Point clé : l’IA ne remplace pas la biologie expérimentale, elle l’optimise. Le gain n’est pas un fantasme de réduction de coûts à 90 %, mais un raccourci sur les cycles qui compte dans les moments critiques. C’est ce qui fait la différence entre une belle promesse et un produit pharma viable.
À lire également :
Tamtam, la solution SaaS dédiée à la sales intelligence, réussit à lever 3 millions d’euros
Dans un marché de la vente B2B en pleine mutation, Tamtam s’est imposée en moins d’un an parmi les startups SaaS les plus prometteuses. Sa…
Partenariats en R&D : leçons tirées de Sanofi et opportunités pour Servier, Ipsen, et la biotech française
Le partenariat précoce avec Sanofi a posé une pierre angulaire : utiliser la plateforme pour des pistes Covid-19. Pas seulement un logo sur un slide : un test grandeur nature des workflows entre data scientists, biologistes et cliniciens. Ce type d’alliance crédibilise la technologie et aligne l’entreprise sur les standards pharma.
Et ensuite ? L’écosystème français regorge d’acteurs avec des besoins et des architectures R&D variées : Servier pour la cardio-onco, Ipsen sur l’oncologie et les maladies rares, Pierre Fabre pour la dermato-onco, Innate Pharma sur l’immuno-onco, Genfit en NASH, Valneva sur les vaccins, BioMérieux sur le diagnostic, Pharnext sur les maladies neurologiques. Chacun peut tirer parti d’une prédiction accélérée pour prioriser des séries, réduire les échecs tardifs et renforcer les dossiers réglementaires avec des rationales claires.
Concrètement, comment structurer un partenariat utile ? En fixant un périmètre précis (cible, maladies, endpoints), des métriques (taux de hit, lead time), un plan d’échantillonnage, et des milestones durs. Les meilleures collaborations sont celles où la donnée circule dans les deux sens et où la propriété intellectuelle est clarifiée dès le départ. Clarté contractuelle = exécution fluide.
- 🤝 Modèle coopératif : co-développement sur une cible, partage de data, co-propriété des résultats.
- 💼 Modèle service+ : paiement par étapes sur des livrables mesurés (séries priorisées, modèles validés).
- 🎯 PoC rapide : 90 jours pour prouver la corrélation prédiction/résultat sur une cible restreinte.
- 🔐 IP claire : clauses sur la réutilisation des features et la confidentialité des datasets.
Cas de figure : un programme d’onco chez Ipsen. L’intégration de la plateforme pour pré-qualifier des milliers de candidats avant synthèse peut économiser deux cycles humides. Même logique pour Servier sur une cible cardio-onco : prioriser les séries avec des contraintes ADMET intégrées dès le scoring.
| Acteur | Cas d’usage | Indicateur de succès |
|---|---|---|
| 🧪 Sanofi | Criblage accéléré (ex. infectieux / onco) | Cycle time réduit et séries plus robustes |
| 🏥 Servier | Optimisation lead en cardio-onco | Taux de hit amélioré vs baseline |
| 🧬 Innate Pharma | Combinaisons immuno-onco priorisées | Réduction d’itérations wet lab |
| 🧠 Pharnext | Programmes neuro : tri raisonné | Qualité des séries candidates |
| 🧫 BioMérieux | Diagnostics : design d’outils moléculaires | Time-to-prototype |
| 🧴 Pierre Fabre | Dermato-onco, librairies ciblées | Concordance préclinique |
| 🧷 Genfit | NASH : tri computationnel | Signal aux endpoints métaboliques |
| 💉 Valneva | Antigènes/vaccins : design in silico | Échecs tardifs évités |
Tu veux voir comment d’autres acteurs articulent IA et discovery ? Cette recherche vidéo t’aidera à cadrer l’état de l’art.
Retenir l’essentiel : la valeur se mesure en taux de réussite, en coûts évités et en temps gagné. Tout le reste est du bruit.
De la découverte aux essais cliniques : plan d’exécution, Londres et montée en cadence
Passer des maquettes à la clinique n’est pas une simple question d’argent. C’est un enchaînement de jalons réglementés, de recrutements pointus et de dossiers verrouillés. Le plan annoncé : doubler les effectifs pour atteindre environ 120 personnes, ouvrir un bureau à Londres, et engager les premiers essais cliniques avant fin 2025. Traduction : industrialiser la découverte et la transformer en programmes cliniques crédibles.
Londres n’est pas qu’un symbole. C’est un hub pour la BD pharma, l’accès aux talents cliniques, et une passerelle vers les États-Unis. Les deals se signent plus vite quand les équipes peuvent rencontrer, négocier et itérer sur place. Et pour les profils rares (chimie computationnelle, regulatory, trial design), le bassin de talents aide à accélérer.
Côté exécution, un roadmap solide se lit par jalons. Pas de promesses vagues, mais des étapes datées, des responsabilités claires et des métriques. Le recrutement doit suivre un ordre utile : team clinique, data ops, qualité, puis renfort BD. L’empilement sans articulation est un piège classique.
- 🧑⚕️ Clinique : protocoles, CRO, sites, critères d’inclusion, endpoints.
- 🧪 Translational : biomarqueurs, cohérence mécanistique, plans d’échantillonnage.
- 🗂️ Réglementaire : IND/CTA, qualité documentaire, pharmacovigilance.
- 🤝 BD : partenariats, co-développements, options de licensing.
| Jalon | Livrable | Indicateur clé |
|---|---|---|
| 📊 Préclinique | Données robustes sur 2-3 programmes | Reproductibilité et safety |
| 📄 IND/CTA | Dossier complet | Acceptation sans hold majeur |
| 🏥 Phase I | Design et sites signés | Inclusions dans le délai prévu |
| 🧬 Biomarqueurs | Plan translational détaillé | Signal pharmacodynamique détecté |
Un point souvent sous-estimé : la qualité des données cliniques dépend de la rigueur des plans translational. Si la prédiction in silico soutient des hypothèses biomarqueurs claires, la lecture de l’essai devient plus rapide et plus probante. C’est une extension logique de l’ADN d’Aqemia : réduire l’incertitude, partout où elle coûte cher.
Besoin d’inspiration sur l’organisation des essais et la gouvernance des datas en clinique ? Cherche des retours d’expérience pragmatiques qui parlent recrutement, endpoints, et reméditions.
Au final, le passage à l’échelle se joue sur trois leviers : des talents, des process et des deals. Avec 38 M€, il faut viser des résultats visibles en 12 à 18 mois. C’est la durée d’attention du marché.
Architecture de confiance : comment prouver la valeur face aux géants et aux régulateurs
Pour imposer un standard, il faut de la confiance. Face à des acteurs comme Sanofi ou Ipsen, et sous l’œil des régulateurs, la crédibilité se gagne au scalpel : documentation, reproductibilité, auditabilité. La promesse d’une technologie 10 000x plus rapide n’a d’intérêt que si elle s’accompagne d’une méthodologie vérifiable finement.
Quatre piliers bâtissent cette architecture. D’abord, une gouvernance des données impeccable : catalogues, lignées, accès, contrôle des versions. Ensuite, des protocoles d’évaluation publics et privés : benchmarks, sets de validation, ablations. Troisième pilier, une traçabilité des modèles : hyperparamètres, feature stores, cartes d’activation. Enfin, une gestion des risques : biais, incertitudes, plans de remédiation.
- 📚 Data : standardise les schémas, impose des contrôles d’intégrité, journalise les modifications.
- 🔎 Éval : définis des benchmarks partagés avec les partenaires, documente les écarts.
- 🧮 Modèles : versionne, attache les artefacts, signe les modèles déployés.
- 🛡️ Risques : scénarios d’échec connus, garde-fous, seuils d’alerte.
Les partenariats peuvent, là aussi, renforcer la confiance. Un projet co-signé avec BioMérieux (diagnostic) ou Pierre Fabre (dermato-onco) peut aligner discovery et clinique autour de biomarqueurs mesurables. Les alliances avec Innate Pharma, Valneva ou Genfit offrent d’autres terrains d’épreuve, chaque aire thérapeutique apportant ses contraintes et ses preuves attendues.
| Pilier | Pratique recommandée | Effet attendu |
|---|---|---|
| 🧱 Gouvernance | Data catalog + access control | Données fiables, audits plus rapides |
| 🧪 Validation | Benchmarks ouverts/clos | Confiance des pairs et des partenaires |
| 📦 Packaging | Feature store et artefacts versionnés | Reproductibilité intra/inter-projet |
| 🚨 Gestion des risques | Plan de réponse aux écarts | Moins d’interruptions en clinique |
Face aux régulateurs, la clarté paie. Une plateforme bien documentée montre qu’elle ne remplace pas la biologie, mais qu’elle la dé-risque. C’est précisément ce que cherchent les comités d’éthique et les autorités : comprendre comment une décision a été prise, avec quelles limites, et comment elles sont compensées. Si tu prépares un dossier, écris pour un lecteur sceptique. C’est lui qu’il faut convaincre.
Le niveau d’exigence élevé protège aussi l’écosystème contre l’emballement. Quand la preuve est la règle, seules les méthodologies solides passent. C’est sain, et c’est ainsi qu’Aqemia peut s’installer durablement comme un standard de découverte accélérée.
Ce que tu peux copier dès demain : playbook actionnable inspiré d’Aqemia
Tu n’es peut-être pas une biotech, mais le pattern est transposable. Transforme une techno en produit, un produit en résultats, des résultats en traction. Voici un playbook simple et dur : pas de vernis, des étapes.
Commence par clarifier ta thèse. Chez Aqemia, le message est net : IA + physique pour réduire les cycles et améliorer la priorisation. Si tu es une startup deeptech, pose la promesse en une ligne, avec une métrique (vitesse, coût, qualité). Ensuite, habille-la de preuves : partenariats (ex. Sanofi), publications, benchmarks.
- 🧭 Positionnement : une phrase, un chiffre, une preuve (et rien d’autre).
- 🛠️ Produit : un pipeline compréhensible par l’utilisateur final (pas par les ingénieurs seulement).
- 📢 Go-to-market : contenus utiles, cas concrets, comparatifs honnêtes.
- 💬 BD : parle métiers (clinique, régulatoire), pas techno pour la techno.
Côté marketing et SEO, arrête les billets génériques. Écris des contenus qui aident vraiment : checklists régulatoires, matrices d’évaluation, retours d’expérience. Publie des pages “How we evaluate candidates” avec détails concrets. Tu attires les bons prospects en montrant comment tu travailles, pas en répétant des buzzwords.
| Message | Preuve | CTA |
|---|---|---|
| ⚡ Vitesse x10 000 | Études internes + cas partenaire | Demander un PoC 90 jours |
| 🎯 Précision utile | Corrélations wet lab | Voir protocole d’évaluation |
| 🌍 Échelle internationale | Bureau à Londres, deals | Prendre un rendez-vous BD |
Besoin d’un exemple ? Imagine “HelixNova”, une startup d’outils diagnostics. Elle publie une page “Pipeline d’évaluation” avec schémas, un comparatif honnête avec trois alternatives, un template de cahier des charges en téléchargement. Résultat : un trafic qualifié, des cycles de vente raccourcis, et surtout des discussions orientées preuves.
Pour t’inspirer sans perdre de temps, cible des contenus vidéo qui vont droit au but et nourrissent ton plan.
Voilà la ligne : une promesse claire, des preuves visibles, un parcours d’achat sans friction. Le reste, c’est du bruit.
En quoi la levée de 38 M€ d’Aqemia change concrètement la donne ?
Elle finance l’industrialisation : doublement des effectifs (~120), ouverture à Londres pour accélérer le business et la clinique, et passage à des essais avant fin 2025. L’objectif : convertir la vitesse de prédiction en résultats cliniques mesurables.
Quelle est la différence technologique clé d’Aqemia ?
La combinaison IA générative + physique statistique/quantique pour scorer jusqu’à 1 million de molécules par jour, avec des contraintes physiques qui améliorent la pertinence des candidats par rapport au docking classique.
Quels types de partenaires peuvent tirer parti de la plateforme ?
Grandes pharmas (Sanofi, Servier, Ipsen), biotechs spécialisées (Innate Pharma, Genfit, Pharnext), vaccins (Valneva) et diagnostics (BioMérieux). Le bénéfice : priorisation plus rapide, moins d’essais inutiles, meilleure préparation réglementaire.
Comment mesurer la valeur d’un partenariat IA en discovery ?
Par des KPIs durs : taux de hit vs baseline, cycles wet lab économisés, corrélation in silico/wet lab, temps jusqu’à IND/CTA, et coûts évités sur la phase préclinique.
Pourquoi un bureau à Londres ?
Pour accéder à un écosystème BD/clinique international, attirer des profils rares, accélérer les deals et préparer une expansion vers les États-Unis, tout en gardant le cœur R&D fort.

Moi c’est Mariane (avec un seul “n”).
J’ai troqué les process corporate contre des contenus qui claquent (et qui rankent).
Passionnée par le business en ligne, le SEO et l’IA, je transforme les idées floues en stratégies digitales qui font du bruit là où ça compte : dans les résultats. Je crois qu’avec un peu de tech, beaucoup d’audace, et une bonne dose de clarté, on peut faire exploser bien plus que des KPI.




